La relación entre el agua y el fuego es mucho más estrecha de lo que te imaginas.
No iba muy desencaminado Tales de Mileto, el más grande de los siete
sabios de Grecia, cuando, en el siglo VI antes de Cristo, afirmó que el
agua era la sustancia primordial de la naturaleza. Recordemos que, para
los antiguos griegos, había cuatro elementos básicos que, mezclándose en
distintas formas y proporciones, daban lugar a todo lo existente, y
estos elementos eran el aire, el agua, la tierra y el fuego. Y Tales,
observando que el agua puede ser líquida, sólida o gaseosa y que está
presente en la tierra (en forma de humedad) y en el aire (en forma de
vapor), pensó que esa era la esencia última de todas las cosas.
La fórmula del agua, H2O, es sin duda la más conocida de las fórmulas químicas; pero no todo el mundo sabe que es el segundo término de una reacción que representa una combustión: 2H2 + O2 à 2H2O
El hidrógeno es muy inflamable (por eso en los globos aerostáticos se suele usar helio, menos ligero y más caro, pero inerte), y, cuando arde, dos moléculas de hidrógeno se combinan con una molécula de oxígeno para dar lugar a dos moléculas de agua. Así que el agua, en su origen, es fuego, lo que equivale a decir que el fuego -la intensa reacción exotérmica que se produce al combinarse el hidrógeno y el oxígeno- es agua, como intuía Tales.
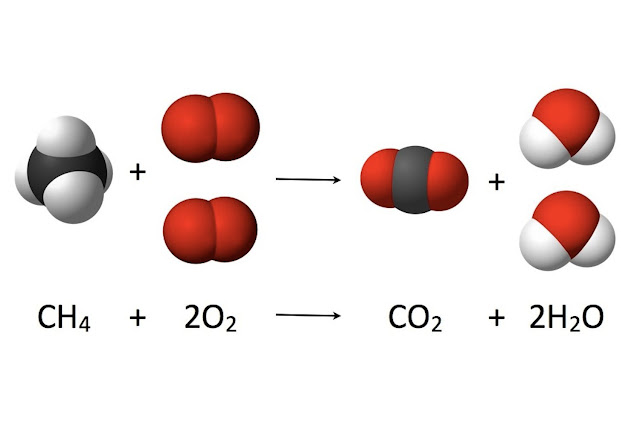
¿Y los demás fuegos? Lo que arde habitualmente en la naturaleza y en nuestros hogares, o en los motores de explosión, no es hidrógeno. ¿O sí? En buena medida sí: los combustibles habituales son hidrocarburos y otros compuestos de hidrógeno y carbono, y cuando arden la combustión produce sobre todo agua y dióxido de carbono. Por ejemplo, al quemar metano, el más simple de los hidrocarburos, se produce la siguiente reacción: CH4 + 2O2 à CO2 + 2H2O
Una molécula de metano se combina con dos moléculas de oxígeno para dar lugar a una molécula de dióxido de carbono y dos moléculas de agua; en este caso el fuego es… gaseosa muy caliente.
Algo parecido ocurre al quemar alcohol ordinario (etanol): CH3 – CH2OH + 3O2 à 2CO2 + 3H2O
Una molécula de etanol se combina con tres moléculas de oxígeno para formar dos moléculas de dióxido de carbono y tres de agua. En este caso el propio combustible aporta oxígeno y, por otra parte, la proporción de dióxido de carbono es mayor, pero la llama sigue siendo “agua con gas”.
La familiar fórmula H2O significa que una molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno, y sus peculiares características moleculares convierten hacen del agua el “disolvente universal”: muchas de las reacciones químicas que se producen en la naturaleza tienen lugar en medio acuoso, y en otras muchas, como acabamos de ver, se produce agua. Además de la combustión, la más conocida reacción generadora de agua es la de un ácido con un hidróxido, como nos recuerda una frase muy familiar para quienes estudian química: “ácido más base, sal más agua”; por ejemplo, al reaccionar el ácido clorhídrico con el hidróxido sódico, se producen cloruro sódico (sal común) y agua: HCl + NaOH à NaCl + H2O
Su condición de disolvente universal hace que el agua sea fundamental para la vida tal como la conocemos, pues en estado líquido (en el que se mantiene de manera bastante estable entre 0º y 100º centígrados) suministra un medio idóneo para que las moléculas de otras sustancias se muevan libremente y se combinen entre sí. Por eso nuestro cuerpo contiene alrededor de un 70% de agua y no podemos sobrevivir mucho tiempo sin beber. Después de todo, Tales no iba desencaminado.
Tomado de: El País (España)